
Сборник основных формул по химии для ВУЗов

М. А. Рябов, Е. Ю. Невская, Е. А. Сорокина, Т. Ф. Шешко
Сборник основных формул по химии
Краткий справочник студента
I. Общая химия
1. Основные понятия химии
Химия – наука о составе, строении, свойствах и превращениях веществ.
Атомно-молекулярное учение.Вещества состоят из химических частиц (молекул, атомов, ионов), которые имеют сложное строение и состоят из элементарных частиц (протонов, нейтронов, электронов).
Атом – нейтральная частица, состоящая из положительного ядра и электронов.
Молекула – устойчивая группа атомов, связанных химическими связями.
Химический элемент – вид атомов с одинаковым зарядом ядра. Элемент обозначают
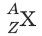
где X – символ элемента,Z– порядковый номер элемента в Периодической системе элементов Д.И. Менделеева, A – массовое число. Порядковый номер Zравен заряду ядра атома, числу протонов в ядре атома и числу электронов в атоме. Массовое число Aравно сумме чисел протонов и нейтронов в атоме. Число нейтронов равно разности A – Z.
Изотопы – атомы одного элемента, имеющие разные массовые числа.
Относительная атомная масса(Ar) – отношение средней массы атома элемента естественного изотопического состава к 1/12массы атома изотопа углерода 12С.
Относительная молекулярная масса(Mr) – отношение средней массы молекулы вещества естественного изотопического состава к 1/12 части массы атома изотопа углерода 12С.
Атомная единица массы(а.е.м) – 1/12часть массы атома изотопа углерода 12С. 1 а.е. м = 1,66 × 10-24 г.
Моль – количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов), сколько содержится атомов в 0,012 кг изотопа углерода 12С. Моль – количество вещества, содержащее 6,02 • 1023 структурных единиц (атомов, молекул, ионов).
n = N/NA, где n – количество вещества (моль), N – число частиц, a NA – постоянная Авогадро. Количество вещества может обозначаться также и символом v.
Постоянная АвогадроNA = 6,02 • 1023 частиц/моль.
Молярная массаM(г/моль) – отношение массы вещества m(г) к количеству вещества n(моль):
М = m/n,откуда: m = М • nи n = m/М.
Молярный объем газаVM (л/моль) – отношение объема газа V(л) к количеству вещества этого газа n(моль). При нормальных условиях VM = 22,4 л/моль.
Нормальные условия:температура t =0°C, или Т =273 К, давление р =1 атм = 760 мм. рт. ст. = 101 325 Па = 101,325 кПа.
VM = V/n, откуда: V = VM• n и n = V/VM.
В результате получается общая формула:
n = m/M = V/VM = N/NA.
Эквивалент– реальная или условная частица, взаимодействующая с одним атомом водорода, или замещающая его, или эквивалентная ему каким-либо другим способом.
Конец ознакомительного фрагмента.
Текст предоставлен ООО «Литрес».
Прочитайте эту книгу целиком, купив полную легальную версию на Литрес.
Безопасно оплатить книгу можно банковской картой Visa, MasterCard, Maestro, со счета мобильного телефона, с платежного терминала, в салоне МТС или Связной, через PayPal, WebMoney, Яндекс.Деньги, QIWI Кошелек, бонусными картами или другим удобным Вам способом.
Приобретайте полный текст книги у нашего партнера: